고혈압 약의 판매중지로 인한 국민의 관심이 고조되고 있다.
8일 식약처 홈페이지가 다운되고 청와대 국민청원 게시판에 다양한 글이 올라오는 등 전국민적 혼란이 가중되고 있다.
식품의약품안전처는 지난 7일 유럽의약품안전청(EMA)이 고혈압 치료제로 사용되는 원료의약품 중 중국산 ‘발사르탄’(Valsartan)에서 불순물로 ’N-니트로소디메틸아민(N-Nitrosodimethylamine, NDMA)’이 확인된 제품을 회수하고 있다고 발표함에 따라 해당 원료를 사용한 국내 제품에 대해서도 잠정적인 판매중지 및 제조·수입 중지 조치를 한다고 9일 밝혔다.
N-니트로소디메틸아민(NDMA)은 WHO 국제 암연구소(IARC) 2A(인간에게 발암물질로 작용할 가능성 있는 물질) 분류돼 있다.
특히 이번 판매중지 및 제조중지 대상이 되는 제품은 해당 ‘발사르탄’을 원료로 사용할 수 있도록 허가된 82개사 219품목이다.
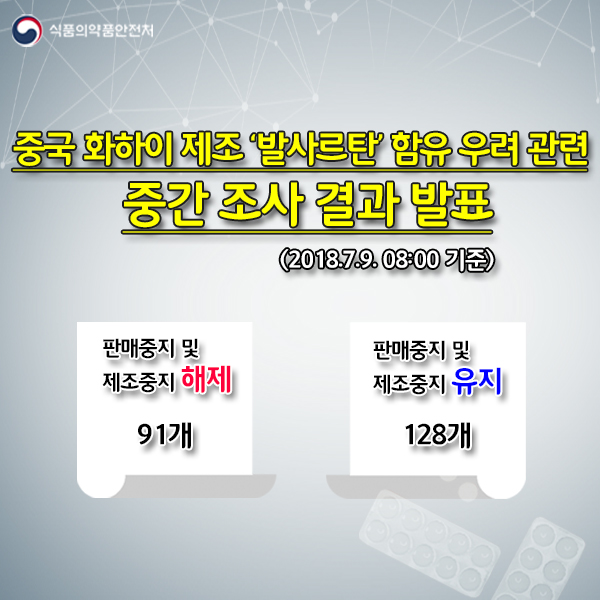
식약처는 이날 해당 원료를 사용하지 않은 것으로 확인된 91개 품목(40개 업체)은 판매중지 및 제조중지를 해제하고, 나머지 128개 제품은 잠정 판매중지 및 제조중지를 유지한다고 밝혔다.
현재 조사가 진행 중인 32개 품목에 대해서도 확인되는 즉시 조사 결과를 공개할 예정이다.
또한 중국 ‘제지앙 화하이(Zhejiang Huahai)’사에서 제조한 해당 원료를 잠정 수입중지 및 판매중지 조치했다.
식약처는 최근 3년간 전체 ‘발사르탄’ 총 제조·수입량은 48만4천682kg(제조:36만8천169kg/ 수입 11만6천513kg)이며, 이번 중국 제조사 ‘발사르탄’은 같은 기간 전체 제조·수입량의 2.8%(1만3천770kg)에 해당된다고 밝혔다.
식약처는 현재 동 불순물 관련 조사(원인, 발생시기 등)를 실시 중에 있으며, 조사 결과에 따라 회수·폐기 등의 필요한 조치를 신속히 취할 예정이다.
다만 이번 잠정 조치는 해당 제품의 ‘NDMA’ 검출량 및 위해성에 대해 확인된 바가 없으나, 소비자 보호를 위한 사전 예방 차원에서 이뤄졌다.
앞서 유럽의약품안전청(EMA)은 중국산 ‘N-니트로소디메틸아민’의 검출량, 복용한 환자에 미치는 영향 등을 검토 중이며, 예방조치로서 지난 5일 회수 중임을 발표한 바 있다.
식약처는 이번 문제가 된 ‘발사르탄’이 함유된 모든 의약품의 경우 의사 처방에 따라 약국에서 조제 후 복용할 수 있는 전문의약품으로서 ‘의약품 안전사용서비스(DUR)’ 시스템에 ‘처방 금지’ 경고 문구가 등록되어 의사가 처방할 수 없어 환자들이 사용하거나 유통되는 것이 원천 차단된다고 밝혔다.
조치대상 의약품을 복용 중인 환자는 임의로 복용을 중단하지 말고 신속하게 의사와 상의하여 줄 것을 당부했다.
해당 제품과 관련성이 의심되는 부작용 발생 등 이상 징후가 있으면 즉시 한국의약품안전관리원(전화 : 1644-6223, 팩스 : 02-2172-6701, 온라인 : www.drugsafe.or.kr에 신고하면 된다.
중국 화하이 제조 '발사르탄'함유 우려 관련 중간 조사 결과 발표 품목 및 업체는 명단은(7.9. 오전 8시 기준) 식약처 블로그(http://blog.naver.com/kfdazzang/221315284722 )를 참고하면 된다.

